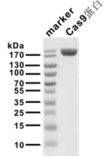
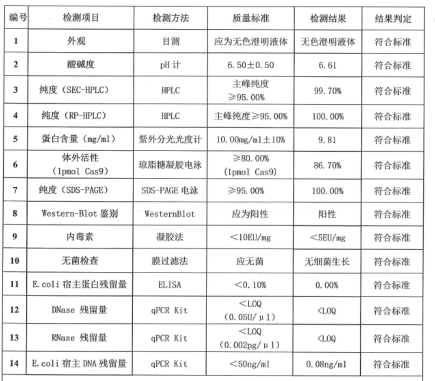
特性及规格:
目的蛋白的氨基酸序列是来源于化脓性链球菌Streptococcus pyogenes 菌种天然的 Cas9 蛋白的氨基酸序列(NCBI GenBank:WP_010922251)。为实现 PR002 蛋白在真核细胞中入核进行基因编辑,在其 N 和 C 端分别加上 SV40 进核信号(SV40.NLS)和 Nuclear 进核信号(Nucleoplasmin.NLS)。上述氨基酸序列进行大肠杆菌偏爱的密码子优化并获得对应核苷酸序列,利用大肠杆菌系统进行蛋白表达。

?液体蛋白在-80℃的条件下存储,能够使蛋白长期稳定。
?收到蛋白后,最好是先将其分装至合适的体积,以避免反复冻融。
?当准备使用时,用含有至少20%甘油的无核酸酶的水溶液稀释蛋白质。
?为了保持蛋白质的稳定性,建议用稀释缓冲液稀释蛋白质。
?提供的所有成分均保存在无核酸酶的灭菌管中,以避免试剂在搬运和存储过程中受到
?核酸酶的污染。
为避免分子间二硫键的形成,建议在Cas9 蛋白中加入终浓度1 mM 的DTT。
其他可能需要的仪器及试剂(根据具体实验需求选择)
仪器:
? PCR 仪,细胞培养箱,流式细胞仪,琼脂糖凝胶电泳系统,聚丙烯酰胺凝胶电泳系统,蛋白转膜系统,水浴锅,紫外分光光度计,电转仪系统,凝胶成像系统,显微镜。
? 细胞培养基,血清,低糖培养基,细胞转染试剂,PBS 缓冲液,TE 缓冲液,10×Cas9 反应缓冲液,T7 体外转录试剂盒,PCR 扩增试剂(如Q5, Tag 等),合成引物。
sgRNA 制备(体外转录)
1)sgRNA 设计网站如下:
?http://chopchop.cbu.uib.no/
?http://crispr.mit.edu/
?http://portals.broadinstitute.org/gpp/public/analysis-tools/sgrna-design
或者使用其他sgRNA 设计网站
注:通常活性指数并没有很好的预测性和准确性,所以不要依赖这些数值,但是off-target 的数值可作参考。
2)sgRNA 引物合成
名称 | 序列 | 引物合成方式 |
正向引物 | aagc (N19)GTTTTAGAGCTAGAAATAG | DSL |
通用反向引物 | AAAAGCACCGACTCGGTGCCACTTTTTCAAGTTGATAACGGACTAGCCTTAT TTTAACTTGCTATTTCTAGCTCTAAAAC | hPage |
注:N19 为2.1.1 中查得的guide 序列
3)合成sgRNA 转录模板
反应溶液的制备:
试剂 | 体积 |
Q5 2X MIX | 10 μL |
正向引物(10uM) | 1 μL |
通用反向引物(10uM) | 1 μL |
ddH2O | 8 μL |
Total | 20 μL |
反应体系 | 反应条件 | ||
模板PCR产物 | 8 μL | 冰水操作 | |
NTP Mix | 10 μL | ||
T7 转录酶 | 2 μL | ||
Total | 20 μL | 37℃ | 2-4 h |
DNAase I | 1 μL | 37℃ | 15 min |
sgRNA 纯化(这里提供磁珠吸附的方法,也可以采取其他方法进行纯化)
1) 将磁珠(Beckman, A63987)从冰箱取出后上下颠倒8 ~ 10 次,并且多次震荡,直到所有磁珠都充分悬浮(在瓶/管底部没有聚集的磁珠)。
2) 在sgRNA 产物中加入1.8 倍体积的磁珠(例如10 μL 产品加入18 μL 磁珠),并在室温下孵育5-10 分钟。将小管放置在磁性分离器上2 分钟。吸出上清液,将管(或管带)留在磁性分离器上。
3) 加200 μL 80%乙醇洗珠,保持管(或管带)在磁性分离器上(无需搅拌)重复乙醇清洗步骤。
4) 清洗结束后,风干5 分钟。加入100 μL RNAase free 水,拌匀,室温下放置2-5 分钟,保持管远离磁性分离器。
5) 将管(或管带)放在磁性分离器上1 ~ 2 分钟,或直到珠子被磁铁吸附。将带有sgRNA的上清液转移到新的管中(尽量不要吸到磁珠)。
6) 使用分光光度计机测定sgRNA 的浓度。选择RNA 浓度测量程序,加载1.5 到2 μL 空白对照及样品,测量后记录浓度。
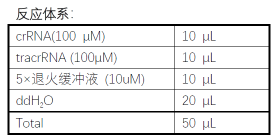
crRNA 和tracrRNA 的制备
如果不是选用sgRNA,而是用crRNA 和tracrRNA 系统,使用前需要将两段RNA 进行退火
处理。

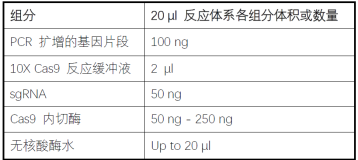
体外酶切活性测试
1) 合成用于检测目标基因的一对引物,要求覆盖所设计的sgRNA 的靶向序列,扩增的
基因片段长度在400-2500bp 之间以便于后续分析。
2) 在室温下按下表组装反应。
3) 于常规PCR 仪中反应,程序为:
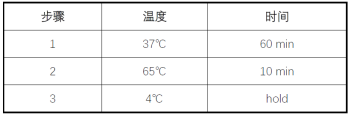
4) 对反应的产物进行琼脂糖凝胶电泳仪,可以通过切开的核酸量来确定体外酶切的效率。
转染指导
化学试剂转染
以293T 细胞和24 孔板为例说明
1) 转染前一天,在24 孔板里每孔铺0.5x105细胞;转染前,37°C 水浴锅温育Opti-MEM生长培养基(高糖DMEM+10%FBS);转染前1 小时细胞可选择性的更换为新鲜生长培养基;
2) 稀释500 ng Cas9 蛋白和200 ng sgRNA 到50 μL Opti-MEM,室温孵育5 分钟。向上述混合液中加入1.5 μl 的EditPro(MTI-GlobalStem:GST-2184)或类似产品(依据产品说明书操作),吹打混匀,室温孵育10 分钟,顺时针方向加入到孔内,温柔的前后摇匀孔板。
3) 孔板放入37°C 、5% CO2 培养箱内培养24-72 小时,更换培养基或根据自己试验需要分析细胞。
电穿孔转染
以293T 细胞和24 孔板为例说明:
1) 电转前1-2 天,细胞传代,以保证实验当天细胞密度达到70-90%。
2) 转染前,37℃温育适量的生长培养基、PBS、Opti-MEM 和TrypLE Express,准备24 孔板,每孔加0.5 ml 含有10%血清的培养基,放到细胞培养箱内预热。
3) 取出培养好的细胞,吸去培养基, 用PBS 清洗后使用TrypLE Express(或类似产品)消化收集细胞。终止消化,取适量消化后的细胞计数,计算出细胞密度。
4) 计算所需要的细胞总数量和所需要的细胞溶液体积,取细胞到1.5 ml 离心管或15 ml锥形管,室温离心去上清,用PBS 清洗后在室温离心去除PBS;
5) 计算所需Opti-MEM 体积,重悬细胞,以确保细胞的密度为5 × 106 cells/mL。轻轻吹打细胞溶液获得单细胞悬液。
6) Cas9 蛋白+sgRNA 室温孵育10 min。理想情况下,样品总体积不大于2 μl。加12 μl细胞悬浮液到复合物中,轻轻地混匀。用neon 系统(ThermoFisher MPK1025)电击细胞,设置参数为(1150V/20ms/2pulses)。将电击后的细胞悬液顺时针滴加到24 孔板中。
注:如使用其他电转系统,请结合实际实验需求调整参数。
7) 转染后48 小时更换新鲜培养基,72 小时后收集细胞。48 小时后可以检测编辑效率。
编辑效率验证指导
目标基因测序(Tide)
1)将野生型细胞群和编辑后的细胞群目标基因片段(包含sgRNA 靶点)分别进行扩增和测序(Sanger 法)。
2) 打开网址https://tide.nki.nl/,点击START TIDE,进入tide 分析界面。依次输入20 nt guidesequence(输入PAM 区前的20 nt 序列)、Crontrol Sample Chromatogram (即野生型细胞目的基因测序文件,一般选取目的基因上400~600bp 作为测序区域)和Test SampleChromatogram (即sgRNA 编辑细胞目的基因测序文件,编辑位点设在测序区域的中间为最佳)。
3) 点击Advanced settings,调整left boundary(通常设为100,测序文件前100 bp 可能有错误)、Decomposition window(即测序的比较区域,通常设为150~600,将编辑位点包含进去)、Indel size range(先设为50),点击Update View,等待结果。
4) 结果Indel Spectrum 显示总基因编辑效率与基因敲除/ 插入情况, 截图保存,Quantification Indel Frequencies 则显示各个长度的基因敲除/插入比例,建立表格保存数据,若Indel size range 远小于50,可降低范围以获得更显著的数据。
目标基因表达鉴定
推荐使用:流式细胞仪检测,WB检测目的基因表达情况。
单克隆分选验证指导
单克隆细胞接种
1) 接种数估算:根据编辑效率和估计细胞的活力,可以估计获得一个敲除(KO)克隆细胞系所需的单个克隆的数量。例如,如果您想要在一个基因的二倍体中均具有突变的纯合KO,并且CRISPR/Cas9 产生靶序列切割效率的为A,那么在任何细胞中敲除两个等位基因的可能性为A2。如果插入缺失导致移码的概率为2/3(如果插入缺失为3 的倍数则可能对原蛋白序列影响不大),则细胞具有纯和KO 的概率约为4/9 x A2。
2) 有限稀释法:建议通过靶向0.8 个细胞/孔来进行有限的稀释,将转染的细胞按照8cells/mL 的密度重悬在完全培养基中,然后在96 孔板上的每个孔中加入100μL。如果按照这种方式接种至少N 个96 孔板,并且预期只有B 比例的细胞能够存活,那么获得纯和KO 克隆的可能数目是42.7 x N x B x A2,单细胞克隆的生存能力因细胞类型而异。一些不希望保留为单细胞的细胞需要以低密度铺板来获得分离良好的克隆,然后必须手动挑选这些克隆进行进一步的筛选。
3) 流式细胞仪分选:单克隆细胞接种可以通过上述有限稀释法或是通过有单细胞分选功能的流式细胞仪来操作获得。选用后者时需要结合具体流式细胞仪的使用规范操作。
4) 单克隆细胞培养:单细胞接种后在显微镜下检查是否为单克隆状态,成功接种的进行标记,继续将平板孵育2-3 周,以扩大克隆种群,以供进一步分析和鉴定。
单克隆验证
对收获的单克隆细胞群进行基因型分析,建议提取细胞群基因组,将酶切靶点前后各200bp
的序列用PCR 扩增出,进行TA 克隆再进行测序,如果所有所测目标序列产生突变,且插
入或缺失的碱基对不为3 的倍数,则这个单克隆细胞群为纯合KO。如果目标基因的表达
可以通过抗体染色检测,也可以通过流式细胞仪进行单克隆验证,纯合KO 中目标基因将
不会表达。
Note: Application as IHC, only suitable for histochemical staining or fluorescence staining of paraffin-embedded sections. Application as ICC/IF, suitable for histochemical or fluorescent staining of frozen sections, as well as chemical and fluorescent staining at the cellular level.
注意:抗体应用为IHC的,抗体只适合于石蜡切片的组化染色或者荧光染色。
抗体应用为IF/ICC的,抗体适合于冰冻切片的组化染色或者荧光染色,以及细胞水平的化学染色和荧光染色。
艾比玛特医药科技(上海)有限公司
上海市徐汇区桂平路333号聚科生物园区1号楼1-3层
邮箱:market@ab-mart.com
应聘职位:hr@ab-mart.com
订购专线:4006-123-828
销售电话:13162017139(微信同号)
技术支持:13162477137(微信同号)
总机:021-34695901
经销商:QQ 402772198
南方经销商负责:手机13122837132(微信同号)
北方及西南经销商负责:手机13122150513(微信同号)

微信客服
邮箱:market@ab-mart.com
应聘职位:hr@ab-mart.com
订购专线:4006-123-828
销售电话:13162017139(微信同号)
技术支持:13162477137(微信同号)
总机:021-34695901
经销商:QQ 402772198
南方经销商负责:手机13122837132(微信同号)
北方及西南经销商负责:手机13122150513(微信同号)

微信客服
沪ICP备17056956号-2 艾比玛特医药科技(上海)有限公司